水を電気分解すると何故12の体積比に分解されるのか 水を電気 正体は、総括すれば、 2 h2o → 2 h2 o係数比はN 2 :H 2 :NH 3 =1 : 3 : 2なので これを解くと、v=168ℓ、a=425 mol となります。 (別解) 標準状態で1molの気体の体積は、種類のよらず224ℓで一体ですから、物質量の比と体積の比は同じになります。第29回:電気分解ファラデーの法則 例題5) 0100mol/L の CuCl 2 水溶液1 L を白金電極板を用いて1A の電流で965 秒間電気分解した。 このとき、陽極板で発生する気体の標準状態の体積と陰極板に生じる固体の質量、および電気分解後の CuCl 2 水溶液の濃度
中学理科 水溶液とイオン4 まとめ編 ママ塾ノート
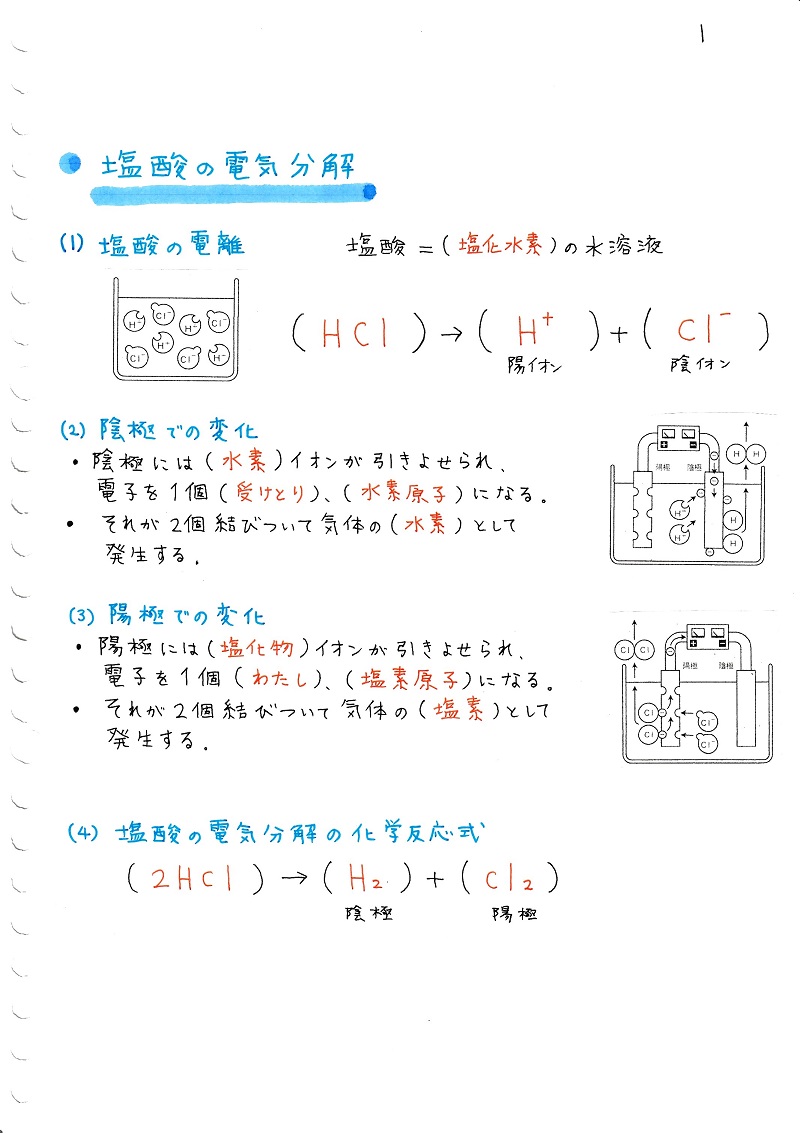
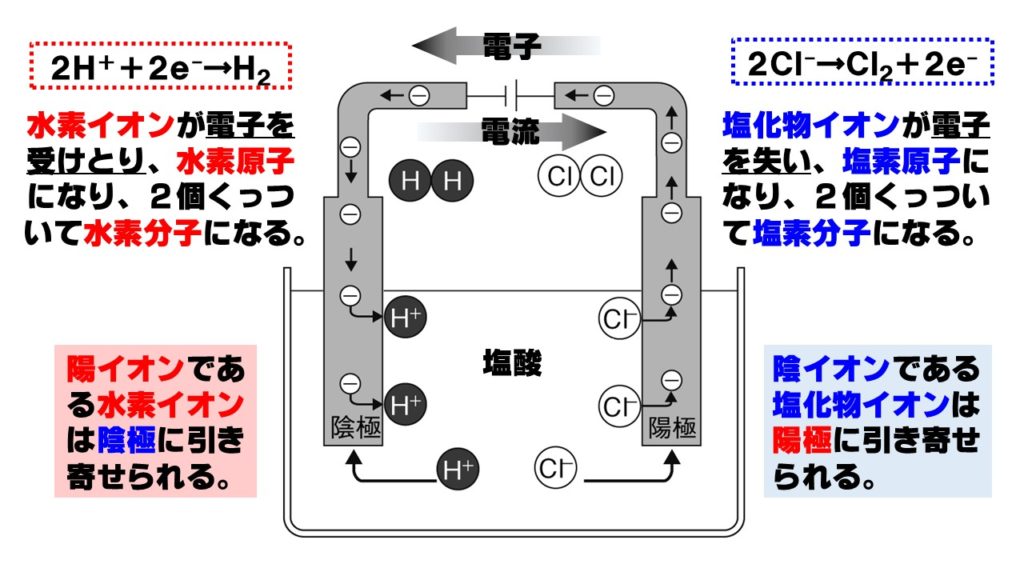
塩酸の電気分解 体積比
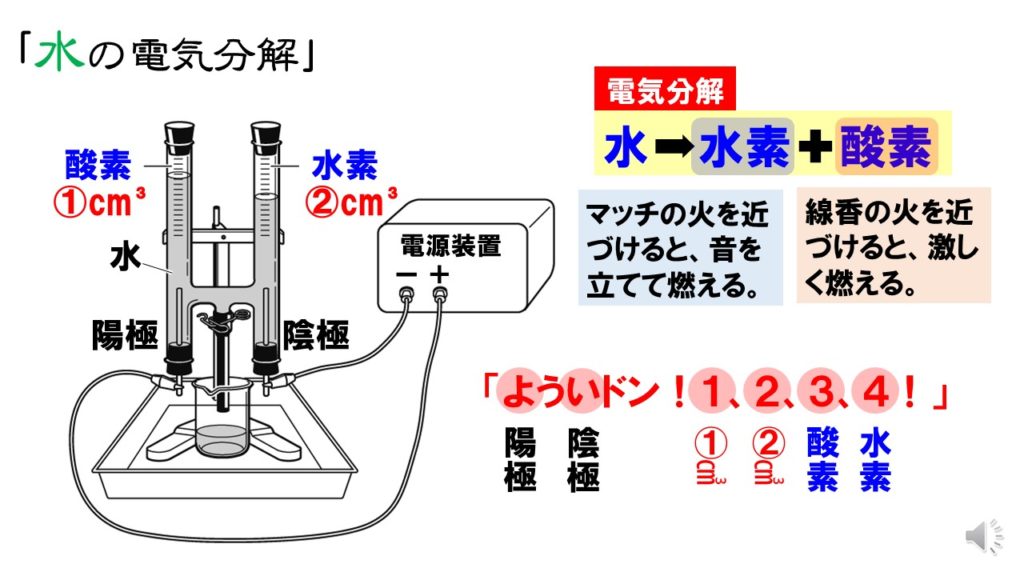
塩酸の電気分解 体積比-つまり塩酸と気体の比は3012=251である。 4回目以降、気体は22gから増えていない。 つまり炭酸水素ナトリウム42gが全て反応したときに発生する気体は22gである。 気体が22g発生するときの塩酸の質量をxgとすると塩酸と気体の比 251から 251=x22 x=55水を電気分解すると,次のように分解されることがわかりました。 水水素酸素 →+ 2HO 2H O222 発生する水素と酸素の体積比は,水素:酸素= です。2:1 ※ に発生する水素は燃えるので, を確認し陰極 マッチの火を近づけて,気体が燃えること ます。



中学理科 水溶液とイオン4 まとめ編 ママ塾ノート
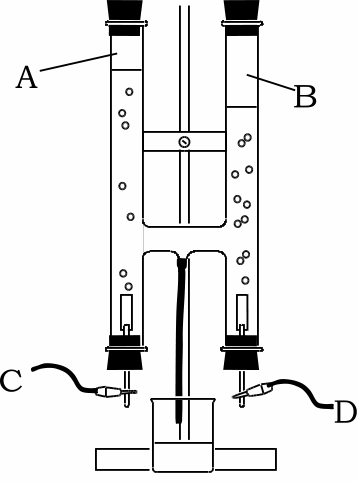
塩酸の化学式はHClなので、HとClが発生する体積比は11です。 (H2Oなら21です) つまり、水素と塩素は同じ体積発生します。 しかし、塩素は水に溶けやすいため、発生してすぐに水の中に溶け込んでしまいます。 その結果、酸素の方が塩素より多く発生したように見えるという訳です。 体積と重さの関係は、物質によって変わります電気分解装置のゴム栓が確実に差し込まれているか確認し、7%の塩 酸100mlを、裏面からろうとを使って入れ、さらに装置を傾け、前面 の槽に塩酸を満たします。 電気分解装置と直流電源装置をみの虫リード線でつなぎます。 安全目めがねをかけます。ホフマ ン型電気分解装置を用い て,水を電気分解し水素 と酸素が2;1の体積比で発生する様子から,発生する気 体の体積 (物質量〉と電気量との間に比例関係が成り立つ ことを示すには有効である1)。しかし,気体の状態方程式
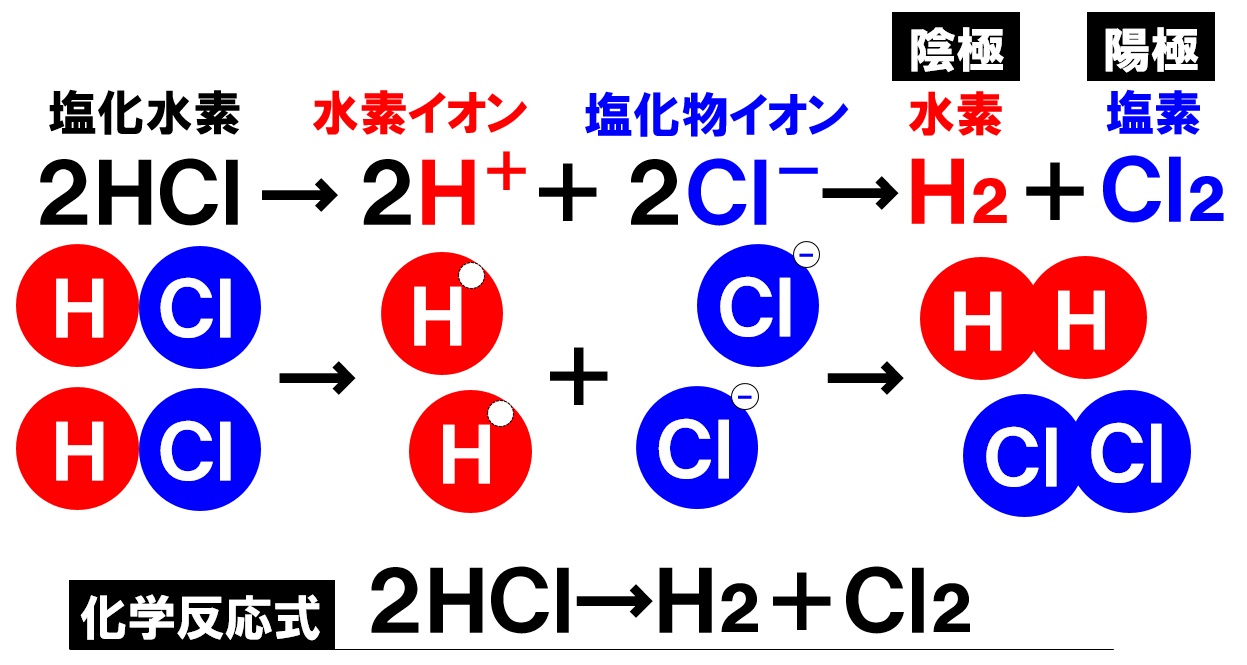
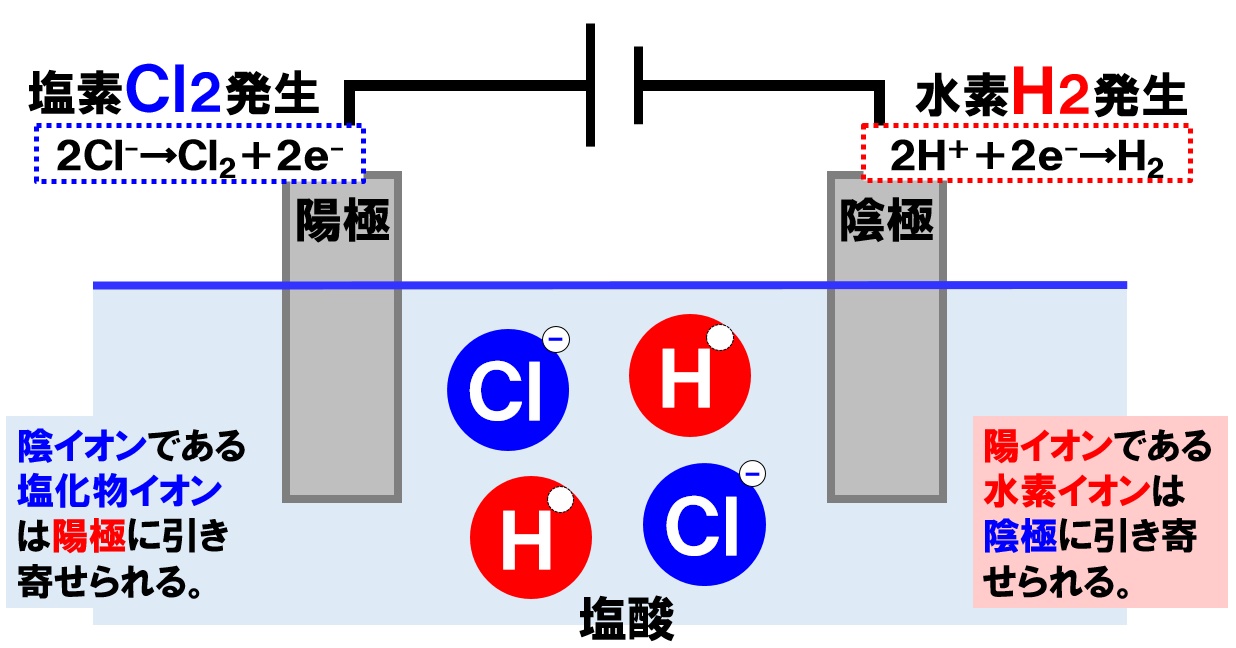
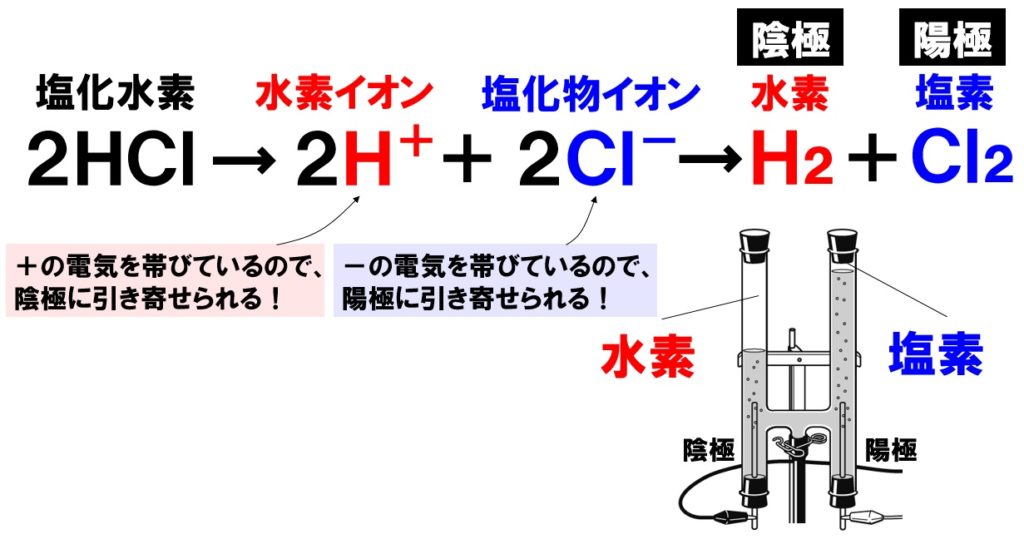
2 分もしくは10 分,加水分解した(表1)。 表1 使用した溶液と触媒 表2 アミロース・アミロペクチン混合水溶液の混合比 (1) 糖度計での検討 002 %,004 %,006 %,008 %,010 %アミロース水溶液3 mL に塩酸3 mL を加え,2 分間加水分解塩酸(えんさん HCl)は、水溶液中で H+(水素イオン)とCl-(塩化物イオン) に 分かれている。 これを 塩酸(えんさん)の電離(でんり) という。 式で表すと、 HCl → H + + Cl - 塩 酸 水素イオン 塩化物イオン となる。 塩酸(えんさん)の電気分解の様子 塩酸(えんさん)に電流を流問題:一問一答「電気分解」 電流を流して、物質を分解することを何といいますか。 水の電気分解で発生する、水素と酸素の体積は何:何ですか。 水の電気分解は、水素が発生するのは+極?-極? 水の電気分解は、酸素が発生するのは Continue reading 電気分解
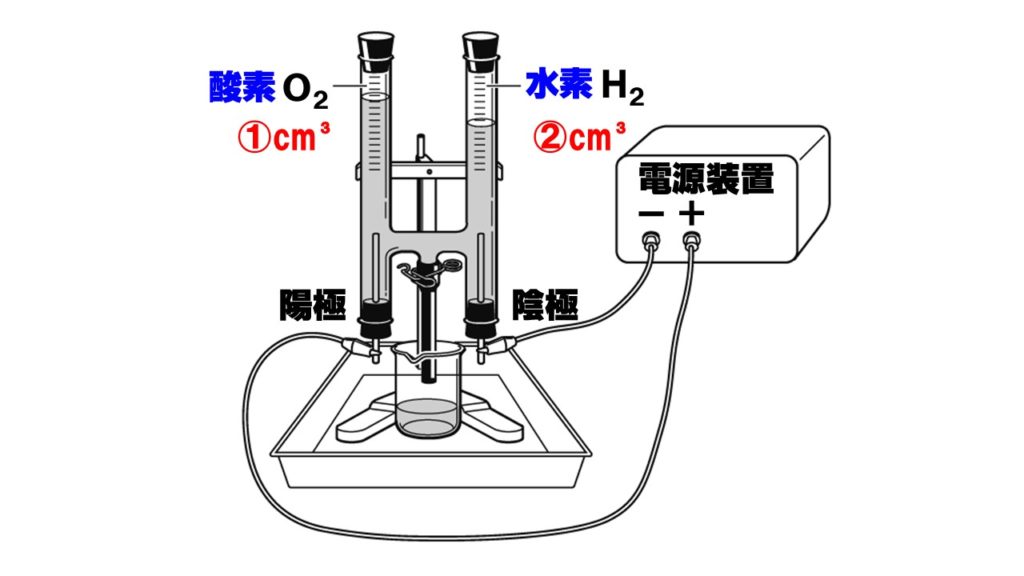
水の電気分解 水を電気分解させ、-極、+極に発生した水素と酸素の 体積を調べてみる。→グラフ ↓ 常に水素と酸素の体積の比が2:1になっている。酸と濃塩酸を1:3 の体積比で混合したもので強い酸化 力をもつ」,と記載されている。この記述に間違いはな いが,わたしの研究室で経験した白金を溶かす混酸は決 して「濃」硝酸と「濃」塩酸の"1:3"混合物ではな かった。 発生する気体の体積比は 水素:酸素=21 ※水酸化ナトリウムを加えるのは、純粋な水が電気を通しにくいからである。 塩化銅の電気分解 塩化銅を電気分解すると銅と塩素に分かれる。 塩化銅→銅塩素 CuCl 2 →CuCl 2 +極から発生するのは塩素、−極に




無機化学の予備知識




中3理科 塩酸の電気分解 発生する気体の性質や化学反応式 Pikuu
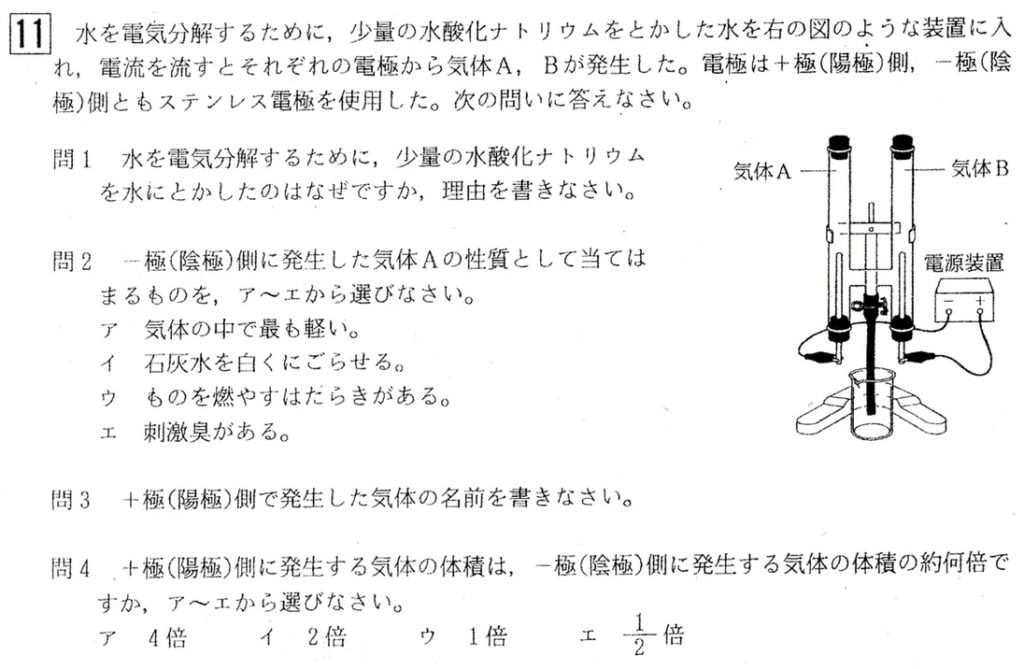
あなたの考え方が成り立つのは、塩酸のモル濃度が既知の場合です。 012 gのMgと反応する塩酸は001 molで間違いないのですが、今回の塩酸のmol濃度は(1)の段階では未知です。 同じ001 molの塩化水素を含む塩酸でも、モル濃度が異なれば、その体積も異なるのです。 故に、 mol比を利用する場合 2塩酸の電気分解の化学反応式 塩酸の 電気分解の化学反応式 を解説するよ。 まず、化学式を一つ一つ確認しよう。 塩酸の化学式 → HCl 水素の化学式 → H 2 塩素の化学式 → Cl 2 この3つの化学式は、 小さい数字水酸化ナトリウム水溶液の電気分解で発生した気体の体積比は, 水素:酸素=2:1 電気分解において,陽極,陰極の反応は, 陽極;酸化反応,陰極;還元反応 この章の実験のポイントは,次の通りです。 1.塩化ナトリウム水溶液を電気分解すると,陽極から塩素が発生し,陰極から水素が




塩酸を電気分解すると何ができる 理科の授業をふりかえる




中学理科 水溶液とイオン4 まとめ編 ママ塾ノート
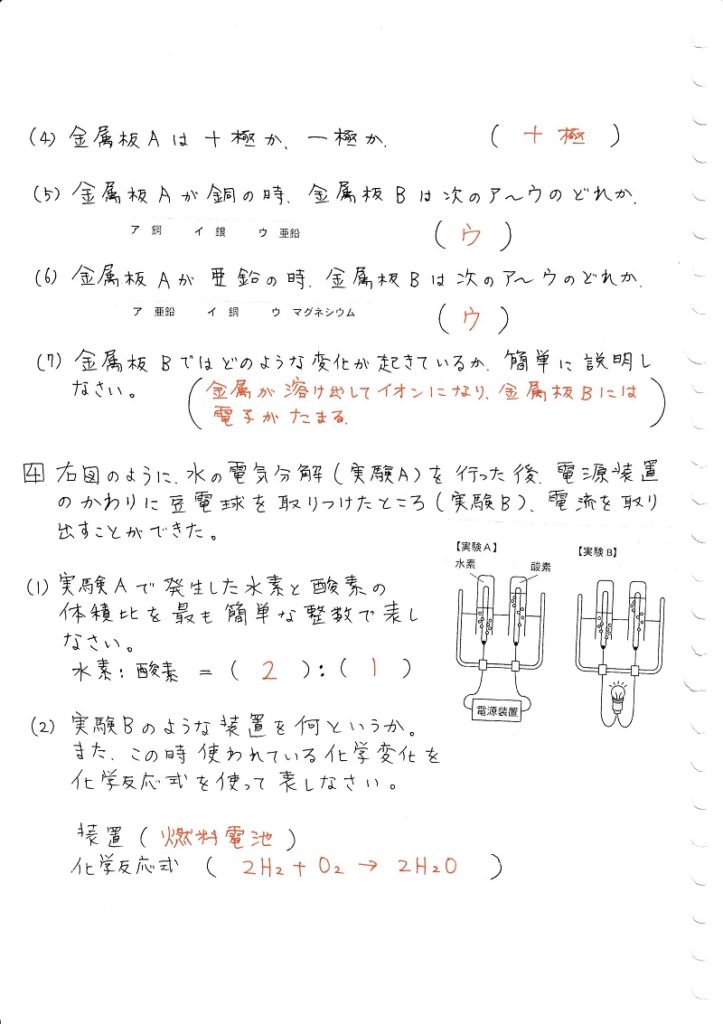
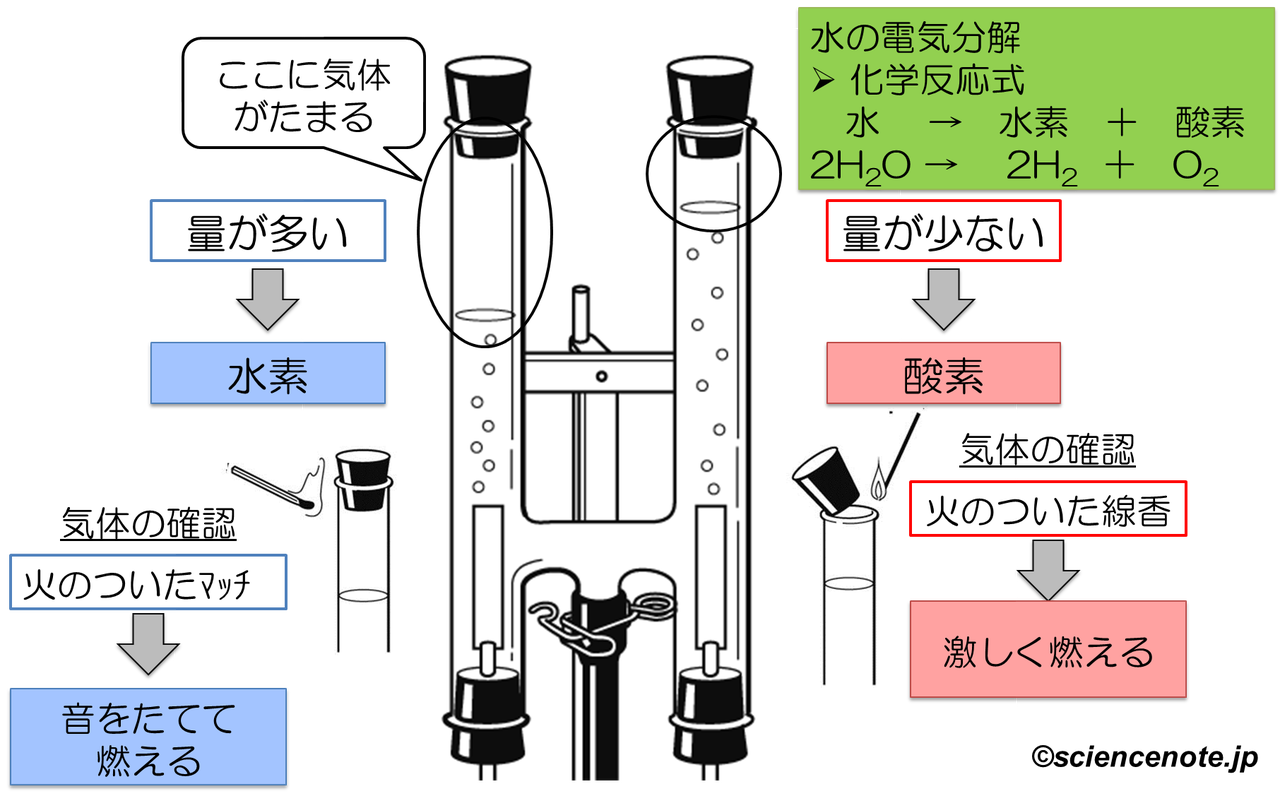
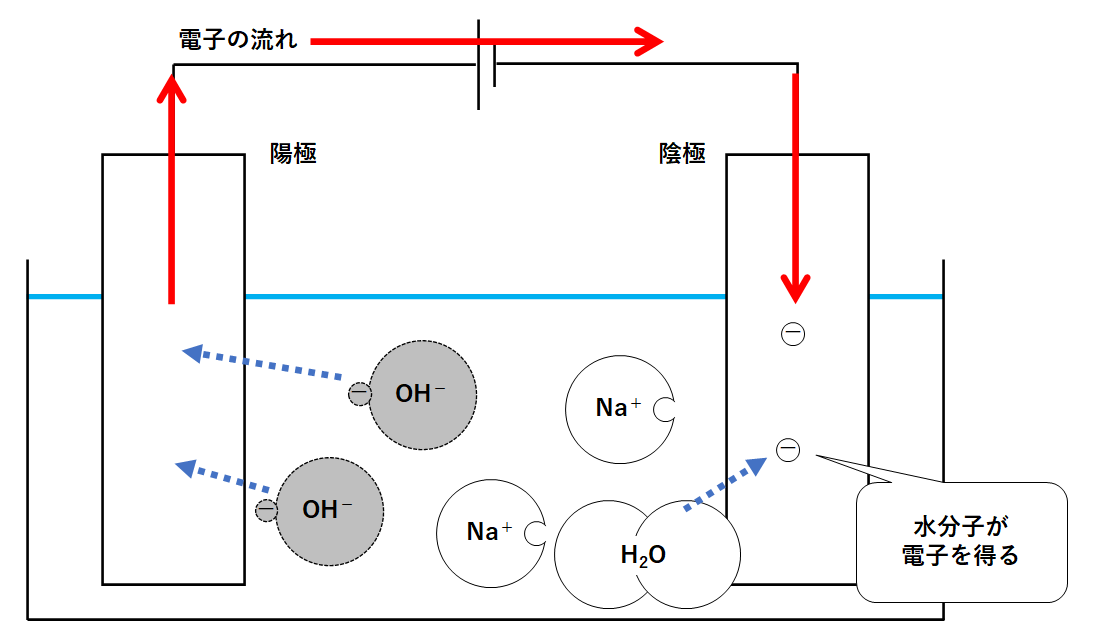
2 水溶液の電気分解による陽極・陰極での生成物 〈陽極〉 硝酸イオンや硫酸イオンは水の電離によって生じる水酸化物イオンより安定なため,水酸化物イオンが陽極で電子を与え酸素ガスが発生する。 4OH → 2H2O + O2 + 4e 水酸化物イオンや塩化物イオンは陽極で電子を与え,酸素ガスや塩素 水分子中の水素原子と酸素原子の質量比が1:8です。 >体積の比になると21になります No。水分子が分解して水素分子と酸素分子に分かれた場合生成する体積比は2:1ですが、一般論から言って、体積比となると2:1とは言えません。 >鉄と硫黄の質量の比と体積の比は同じなのでしょうか? これまでの話と異なる点があります。これらは固体なのです。簡単 中学2年理科。化学変化の中の分解「水の電気分解」について学習します。 レベル★☆☆☆ 重要度★★☆☆ ポイント:発生する気体と体積の覚え方、実験の手順水の電気分解水に電流を流すと、陽極から酸素が、陰極から水素が発生します。水→水素+酸



高等学校化学i 電池と電気分解 Wikibooks



中3理科 水の電気分解をイオンで考える Examee
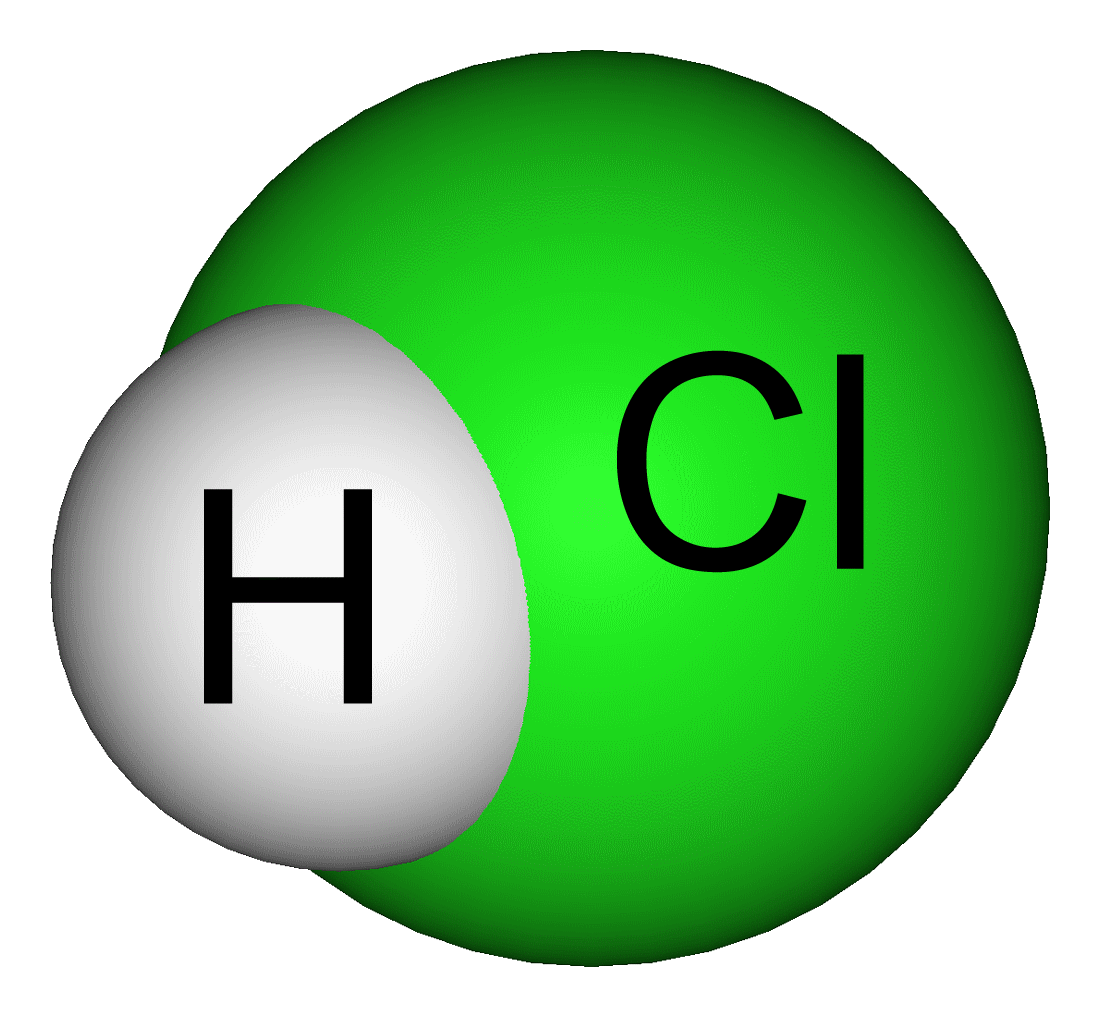
塩酸は、塩化水素水溶液なので2HClとなります。 これを電気分解するので、 2HCl→H2Cl2 この式から、同じ量の水素と塩素が発生していることがわかります。 しかし、塩素は水に溶けてしまうので、実際は、水素の方が多くなります。 間違ってたらすみません。 垢変しました 約3年前 ありがとうございます! この回答にコメントする水の電気分解で発生した,体積比2:1 の水素と酸素の混合気体(爆鳴気)に点火する と,爆発的な反応が起こる。 ポリスポイドを利用したNingHuaiZhou(周,00)によ炭素棒と発生する酸素が何らかの反応をしてしまい,体積 比が : になりにくいという欠点がある。また,電極が破 壊されることがある )。 ニッケル電極は,硫酸の場合,腐食が激しくなる。 白金電極なら,ここまで述べた欠点はないが,高価であ り生徒実験を行うだけの数をそろえるのが�



高等学校化学i 電池と電気分解 Wikibooks




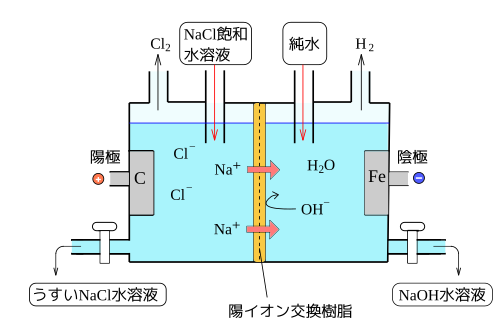
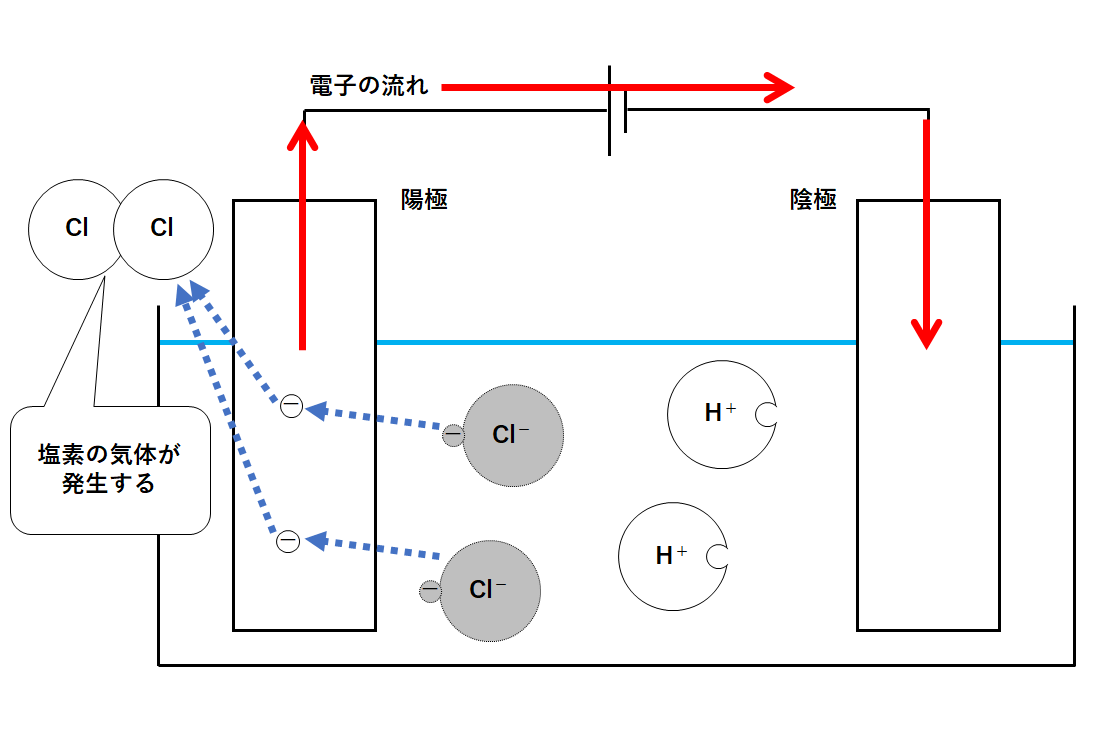
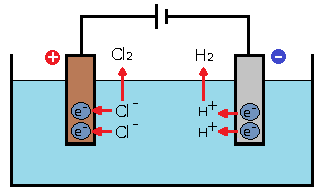
食塩水の電気分解における電極での反応式 イオン式 陽極で塩素が発生し 陰極で水素が発生する理由
ここで塩酸(2 +1)や硫酸(1+3)とあるのは,体積比でそれぞれ濃 塩酸と純水が2:1,濃硫酸と純水が1:3 の混合物の意 である。試料はケイ素の含有率によって10 g もしくは 30 g を用いる。表1 に示す分解操作を行った後,二酸水を電気分解すると,水→水素+酸素の 反応がおこる。 発生する気体水素と酸素( )の体積比は, 水素:酸素=2:1 になる。上の暗記法 で,「陰極(-)に水素,陽極(+)に酸素が 発生し,その体積比は,水素:酸素 =2:1」ということを丸暗記しておく。磁器・金属容器 を採用耐食性の高い白金めっき付チタン電極なので硫酸や水酸化ナトリウム水溶液から塩酸などの電気分解まで幅広く使えます。 教科書通りに実験できる水の電気分解による化学反応で生成した水素と酸素の体積が整数比(2:1)を示すことを調べられ




水の電気分解における酸素原子と水素原子の質量比 2019年埼玉 中学理科応援 一緒に学ぼう ゴッチャンねる




塩酸の電気分解 中学理科3年1分野 化学変化とイオン3 Youtube
水の電気分解の本質である,陰極と陽極に,それぞれ水素と酸素が2:1の体積比で発生すると いう視点があまりないことがわかる。 水の電気分解の実験条件に関する再提案 111 2mol/L て生成 タップできる目次 1 1水の電気分解の実験 11 ①水の電気分解の実験動画 12 ②水の電気分解で発生するもの 13 ③水の電気分解で発生する気体の覚え方 14 ④水素と酸素の体積比 15 ⑤水の電気分解で水酸化ナトリウムを入れる理由 2 2水の電気分解の化学反応式 21 ①水の電気分解2/mol は塩酸水溶液の極限当量導電率であ る. ここで(10)( 12)式を(2)式に代入すると,以下の電 解液の塩酸濃度C に関する方程式が得られる. (13) 前報と同様に電解槽内での塩酸の電気分解反応およ び微酸性電解水中での各成分の解離平衡を考慮




塩酸の電気分解 清教学園中高等学校 理科部 Teacup ブログ Autopage



Q Tbn And9gcrkhhfxh9ewdhnegpdbbwawwkdrycduhcvh0wzn Vz56hg0qmyp Usqp Cau
⑤ 電気分解中に発生する気体によって電解液が押し 出されるので,ピペットの下に空のスチロール容器を く。この電気分解で捕集した水素と酸素の体積比は, 2:1にならないと考えられる。 4.圧電素子による水素の燃焼実験 水素を燃焼させるには,通常マッチを用いるが,安 全面を 例えば,塩酸の電離について考えてみましょう. 塩酸は化学式でHClと書き,水素イオン (H)と塩化物イオン (Cl–)が結びついてできている物質 です. この塩酸が溶けると,電離して,陽イオンである水素イオンと陰イオンである塩化物イオンに分かれます. これが,塩酸の電離です. 塩酸の電離: HCl → H Cl –分解がおこるものはどれか,次のア~エの中から1 つ選び,その記号を書け。 ア エタノールと水の混合物を試験管に入れて加熱する。 イ うすい水酸化ナトリウム水溶液とうすい塩酸を混ぜあわせる。 ウ 鉄粉と硫黄粉を混ぜあわせて試験管に入れて加熱する。




2 の解説をよろしくお願いします この問題の意味もよくわかりません Clear




電気分解1 塩酸の電気分解 無料で使える中学学習プリント
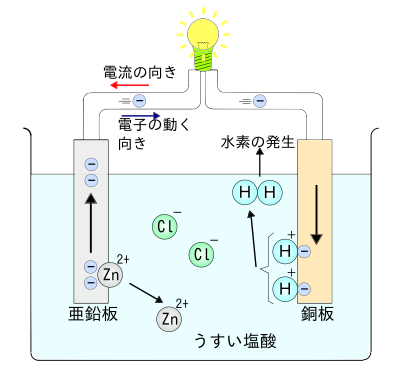
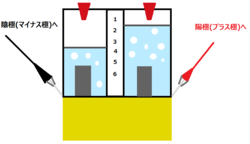
水の電気分解 水 ②( )+ 酸素 ・純粋な水は電流が流れないので、③( )などを溶かしてから電流を流す 水の電気分解では、陰極側に④( )が発生し、陽極側に⑤( )が発生する。 水の電気分解 右の図のような装置で、水の電気分解を行ったところ、 陰極側からは水素が、陽極側からは 塩酸を電気分解すると、 塩素と水素が発生します。 このとき、水素の方が 多く発生する理由はなぜでしょうか。 『水素原子の方が、大きい(質量)から』 ということで、あっていますでしょうか? ・・よろしくお願い致します!



Q Tbn And9gcr87ijnugimxlb5k0rpdqorxtddn3wtfac3lnx7jgpzaokv Usqp Cau



Www Tochigi Edu Ed Jp Center Cyosa Cyosakenkyu Kyokasido H22 Pdf New Kagaku All Pdf



化学変化と実験3




理科3年 化学 イオン 電池 酸アルカリ エネルギー イオン 要点 原子 イオン 原子核は の電気を帯びた陽子と電気を帯びていない中性子から成り立っている 原子核の周りを の電気を帯びた電子が飛び回っている 陽子と電子の数は同じである




中学理科 水溶液とイオン4 まとめ編 ママ塾ノート




理科3年 化学 イオン 電池 酸アルカリ エネルギー イオン 要点 原子 イオン 原子核は の電気を帯びた陽子と電気を帯びていない中性子から成り立っている 原子核の周りを の電気を帯びた電子が飛び回っている 陽子と電子の数は同じである



中3理科 塩酸の電気分解の定期テスト対策問題 Examee



塩酸 Wikipedia



実験8塩酸の電気分解 3年理科 化学 Takaの授業記録18



Http Www Shotoku Ac Jp Data Facilities Library Publication Kyoiku54 6 Pdf




ケニス株式会社 理科なび 教材の紹介




2 の解説をよろしくお願いします この問題の意味もよくわかりません Clear



Http Www City Iruma Saitama Jp Res Projects Default Project Page 001 010 686 3nennrikakotae Pdf



中3理科 塩酸の電気分解 発生する気体の性質や化学反応式 Pikuu




塩酸の電気分解 清教学園中高等学校 理科部 Teacup ブログ Autopage



中3理科 塩酸の電気分解 発生する気体の性質や化学反応式 Pikuu




塩酸の電気分解 中学生向け




理科3年 化学 イオン 電池 酸アルカリ エネルギー イオン 要点 原子 イオン 原子核は の電気を帯びた陽子と電気を帯びていない中性子から成り立っている 原子核の周りを の電気を帯びた電子が飛び回っている 陽子と電子の数は同じである




号 塩化水素の製造方法 Astamuse




中3化学 塩酸の電気分解 中学理科 ポイントまとめと整理



中3化学 塩酸の電気分解 中学理科 ポイントまとめと整理



図の装置で電気分解をつづけるとうすい塩酸 うすい水酸化ナトリウム水溶液 Yahoo 知恵袋



1




塩酸の電気分解 中学生向け



Soar Ir Repo Nii Ac Jp Record Files Vol 10 3 2 Pdf




中3化学 塩酸の電気分解 中学理科 ポイントまとめと整理



中3化学 塩酸の電気分解 Hiromaru Note




中学理科 水溶液とイオン4 まとめ編 ママ塾ノート




塩酸の電気分解 勉強 Youtube スタディチューブ



Http Www City Iruma Saitama Jp Res Projects Default Project Page 001 010 686 3nennrikakotae Pdf



電気分解とファラデーの法則 基礎からわかる電気技術者の知識と資格




スタディピア 化学変化 分解と化合
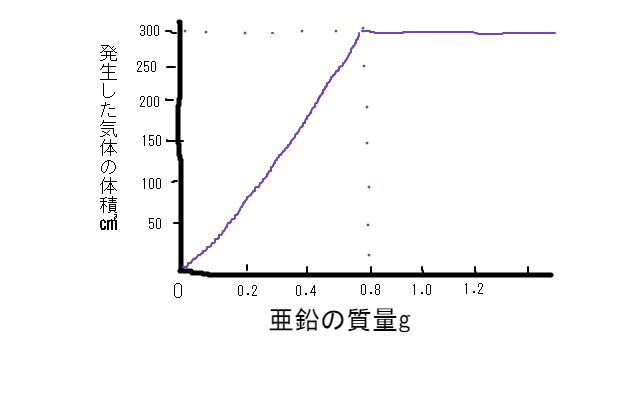



うすい塩酸と亜鉛の反応 グラフ問題 速答方法 中学数学 理科 寺子屋塾の復習サイト




2022年に考えられる電気分解の実験 中学理科応援 一緒に学ぼう ゴッチャンねる




2の 2 が分かりません Clear



Http E Clus Com Cgibin Io Upload File Course 2 Cdd1b12cdcf Pdf



1




塩酸を電気分解すると何ができる 理科の授業をふりかえる
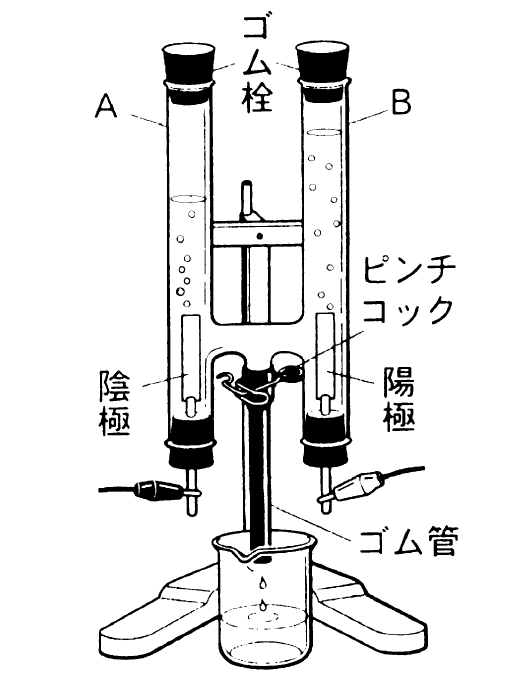



化学変化2



中3化学 塩酸の電気分解 Hiromaru Note




塩酸の電気分解 中学生向け



塩酸の電解




1 の問題なんですけど 答えはグラフから考えていますが Clear




中2 理科 実験問題 水の電気分解 1学期期末テスト 暗記用 赤城 ᐡᐤᐡ




塩酸の電気分解 清教学園中高等学校 理科部 Teacup ブログ Autopage




中3理科 塩酸と塩化銅水溶液の電気分解のポイントと練習問題




中3理科 塩酸と塩化銅水溶液の電気分解から電解質と非電解質の違いを学ぶ Irohabook



Www City Asahikawa Hokkaido Jp Kurashi 218 251 257 D D Fil 12rika03 Pdf
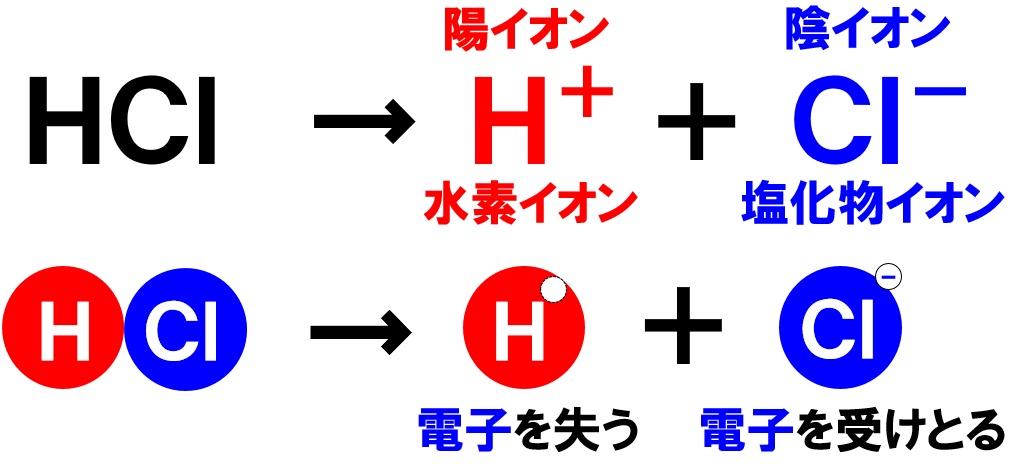



中3理科 塩酸の電気分解のポイント Examee



塩酸の電気分解 3年理科 Takaの授業記録11



中3化学 塩酸の電気分解 Hiromaru Note
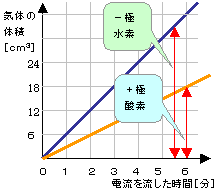



質量保存の法則 Hello School 中学理科 ハロ理科 No 12



中3理科 塩酸の電気分解のポイント Examee



Assist Edu Com Wp Content Uploads 1b9adf4a9090b Pdf




号 電解槽の製造方法 Astamuse



ケニスオンラインショップ 商品詳細ページ



15年 北海道学力テスト中2 理科 第2回の過去問題 詳しい解説を公開します 家庭教師のsora




中3化学 塩酸の電気分解 中学理科 ポイントまとめと整理




スタディピア 化学変化 分解と化合



塩酸の電気分解について 理科の部屋 学習教材の部屋




塩酸の電気分解 中学生向け



Kamanabi Jimdo Com App Download E6 B0 B4 E6 Ba B6 E6 B6 B2 81 A8 Ef 92 Ef 8 E5 Ad A6 E6 9c 9f E6 9c 9f E6 9c Ab Ef Pdf T



理科 働きアリ The 2nd




中3化学 塩酸の電気分解 中学理科 ポイントまとめと整理




中3化学 塩酸の電気分解 Hiromaru Note



Http Www City Iruma Saitama Jp Res Projects Default Project Page 001 010 686 3nennrikakotae Pdf




学校のテストとは違う入試に出る独特な問題 水の電気分解 2011年京都 中学理科応援 一緒に学ぼう ゴッチャンねる



実戦問題2年 分解




中3化学 塩酸の電気分解 中学理科 ポイントまとめと整理



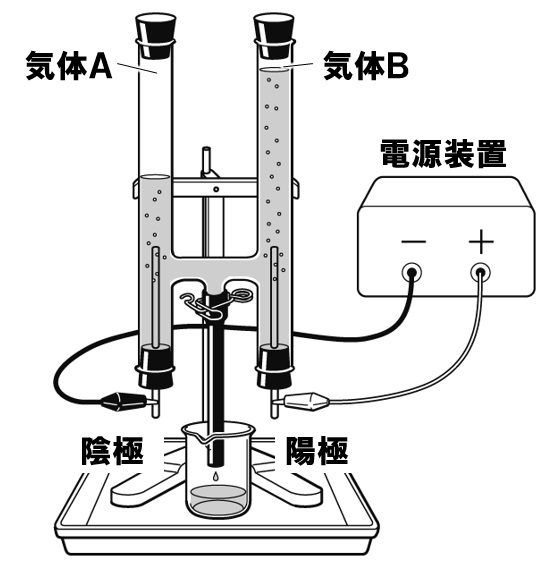
中3理科です 塩酸の電気分解です Aは水素bは塩素ですよね Aとbの Yahoo 知恵袋



中2化学 水の電気分解 Hiromaru Note



中学校理科 第1分野 化学変化と原子 分子 Wikibooks



中2理科 水の電気分解 覚え方や実験の手順 Pikuu




この問題の 2 を教えてください お願いします Clear




化学講座 第29回 電気分解 ファラデーの法則 私立 国公立大学医学部に入ろう ドットコム



中3化学 水の電気分解 中学理科 ポイントまとめと整理




授業 化学変化と原子 分子 水の電気分解 理科 中2 群馬県 Youtube



2



塩酸の電気分解について 理科の部屋 学習教材の部屋



薄い塩酸を電気分解した際 発生した気体の量についての問題で 発生した塩素が酸素 Yahoo 知恵袋




理科3年 化学 イオン 電池 酸アルカリ エネルギー イオン 要点 原子 イオン 原子核は の電気を帯びた陽子と電気を帯びていない中性子から成り立っている 原子核の周りを の電気を帯びた電子が飛び回っている 陽子と電子の数は同じである
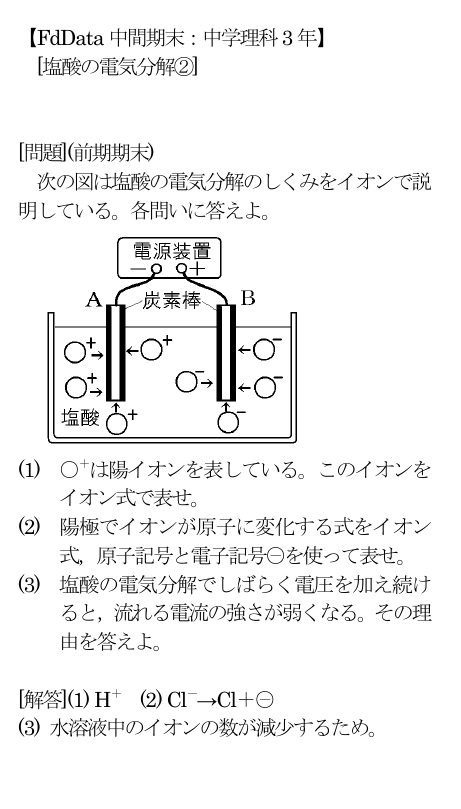



Fddata中間期末 中学理科3年 塩酸の電気分解 問題 前期期末



電気分解と化学電池 理論 3年理科 化学 Takaの授業記録18




理科のページ 続きはwebで 年04月27日



分解



水の電気分解自分の持っている中学参考書 添付画像 では 陰極側に水素 Yahoo 知恵袋



分解
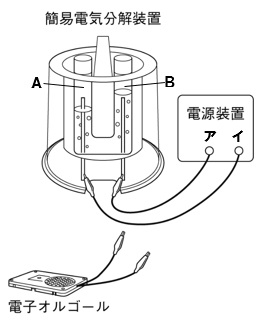



中3理科 燃料電池の定期テスト対策問題 Examee



塩酸の電解



中3理科 塩酸の電気分解のポイント Examee



0 件のコメント:
コメントを投稿